この講義の内容は下記のYouTubeサイト(再生リスト:Life Science Lectures for You ・動画による生命科学講義)で動画として視聴できます
https://youtu.be/comign soon
1. 講義内容の概要
この講義ではDNAのメチル化を介した転写抑制のメカニズムについて解説しています。陸上植物ではこの機構により,転移活性のあるトランスポゾンなどの転写を長期安定的に抑制して有害な突然変異を防いでいます。
Key words:トランスポゾン, PTGS, TGS, DNAのメチル化修飾,H3K9me2,siRNA, Pol IV, Pol V, 5mC, 2本鎖RNA. 非標準的なRdDM, DRM2, MET1, CMT3, CMT2、AGO
2. small RNAが誘導する遺伝子の発現抑制

21-24nt程度のsiRNAやmiRNA (small RNA)が引き金となるPost Translational Gene Silencing (PTGS)が発見され,RNA interference (RNAi)として命名されました。このRNAiによるPTGSは,ほぼ全ての真核生物が持っている機構です。
その後,siRNAやpiRNAが引き金となるTranscriptional Gene Silencing (TGS)型のRNAiも発見されました。
RNAiによるTGSは広く真核生物のどのような細胞でも観察される機構ではなく,この機構は動物の生殖細胞,分裂酵母,陸上植物などに限定されています。
陸上植物で見られるRNAiによるTGSは、特にRNA dependent DNA Methylation, RdDMと呼ばれています。RdDMにより植物ゲノム中のトランスポゾンや反復配列,外来ウイルスなどの有害な遺伝的な因子の転写が長期安定的に抑制されています。この動画では陸上植物のRNA dependent DNA Methylationの機構について解説しています。
3. 陸上植物において現在でも転移活性を持つトランスポゾン

陸上植物でRdDMが進化した理由として,陸上植物では転移活性のあるトランスポゾン種も,またそれらのコピー数も多い事が考えられます。
cut-and-pasteで転移するDNA型のトランスポゾンで転移活性のあるものとしては,Ac/Ds, MuDR, Spm/En, Tam3, mPingが知られています。またcopy-and-pasteでコピー数を増やすレトロ型のトランスポゾンで転移活性のあるものとしては,Tos17, Tnt1/Tto1, Onsenが知られています。
トランスポゾンが活発に転移するとゲノムに有害な変化が多く蓄積される危険性があります。また植物では動物と違って,生殖系の細胞が体細胞から分化するタイミングが非常に遅いために体細胞で起こった変異は生殖系の細胞に受け継がれる可能性が高くなっています。
これに対して,動物細胞では転移活性のあるトランスポゾンの種類も数も限られています。ここではヒトの例を挙げています。
現在,ヒトのゲノムには転移活性のあるDNA型は存在しません。また転移活性のあるレトロ型トランスポゾンとしては,LINE-1とAluが知られていますが,転移活性を持つ分子の数は100コピー程度で,それほど多くありません。また,動物細胞では発生の非常に早い段階で体細胞から生殖細胞が分化するので,その後の発生途中に体細胞で生じたゲノムの変異は次世代に受け継がれる可能性はありません。このような理由から,陸上植物ではRdDMが発達したと考えられます。
4. 外来遺伝子に対するRNA directed DNA Methylationの例
RdDMによって転写が抑制される対象は,トランスポゾンや内在性の反復配列だけではありません。遺伝子操作によって外部から導入された人工遺伝子 (transgene)についてもRdDMによってPTGSが誘導されます。
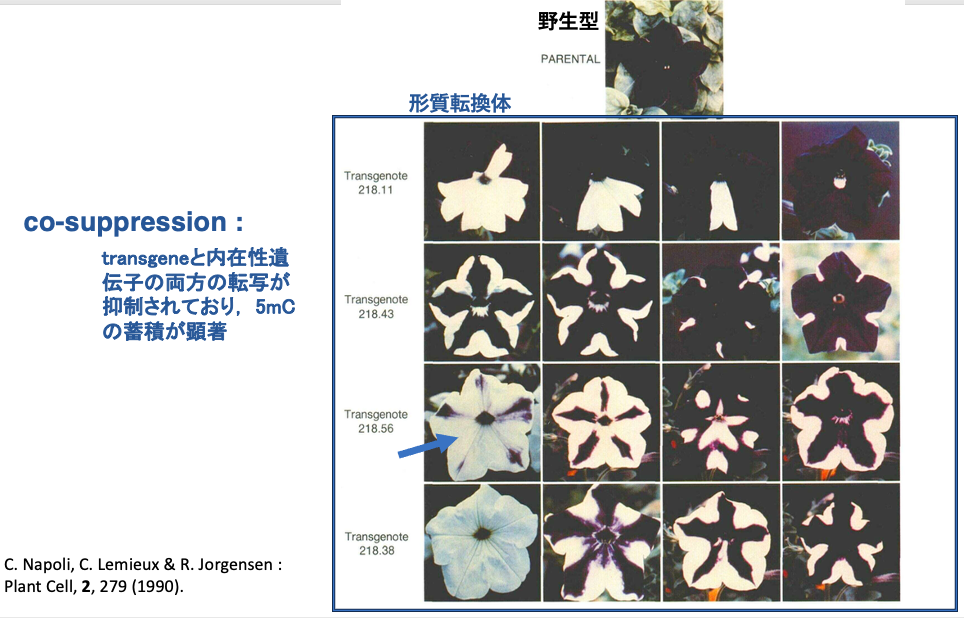
植物においてRdDM経路が発見されるきっかけとなった現象を紹介します。
ペチュニアで紫色のアントシアン系色素合成の律速酵素となっているカルコン合成酵素(chalcone synthase ; CHS)をゲノム内に遺伝子導入で発現させたところ,図に示したような様々な花弁が生じました。紫色の花弁の中に白い領域ができたり,花弁全体が白い花が生じました。
解析の結果,花弁の白い部分では,transgeneと,それに相同な塩基配列をもつ内在性CHS遺伝子の両者に由来するmRNA が現象している事が明らかになりました。transgeneと内在性遺伝子の両方の転写が抑制されることで白色の花弁が現れた事が分かりました。そのため,この現象はco-suppressionと呼ばれました。
その後の研究で,co-suppressionが生じている細胞では,transgeneとそれと相同な内在遺伝子の両方で5mCの蓄積が顕著に見られることが分かりました。また,このようなDNAのメチル化は24nt長のshort interference RNA (siRNA)が重要な役割を果たしていることが分かりました。このような現象の解析を通してRNA directed DNA Methylationの研究が進みました。
5. small RNAが誘導する遺伝子の発現抑制 (広義のRNAi)

陸上植物で見られるRNA directed DNA methylationは,siRNAによる転写後サイレンシング(PTGS)の機構が発展したものだと考えられますので,まず簡単にRNA interferenceによるPTGSの機構を解説します。
RNAiによるPTGSに関して詳しく知りたいヒトは,別の動画をすでにUploadしていますので,そちらを参考にしてください。
6. RNAiよる転写後サイレンシング: 21 ntのsiRNAが関与する翻訳阻害
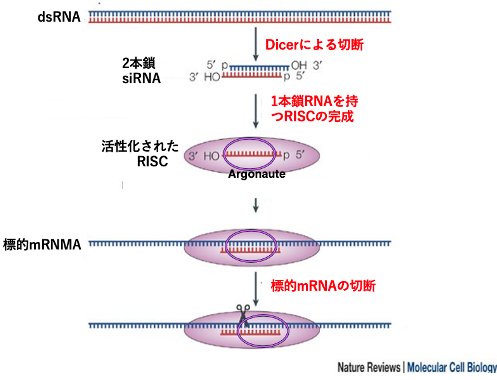
ウイルスやトランスポゾンなどに由来する遺伝子の転写によって作られたmRNAは,RNA dependent RNA polymerase (RDRP)によって2本鎖化(dsRNA)され,Dicerによっておよそ21 ntの2本鎖断片が形成されます。一方の鎖がArgonaute (AGO)に組み込まれ,さらに幾つかのタンパクが加わってactiveなRISCが形成されます。
7. PTGSの機構:RISC結合による標的mRNAの切断または分解促進
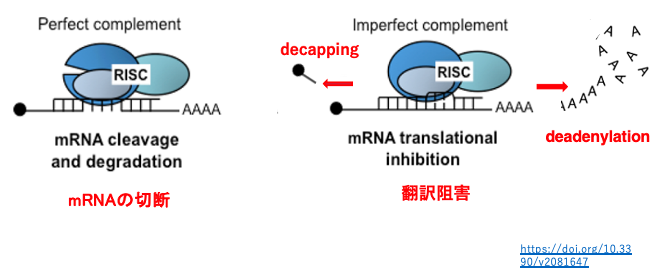
RISC内のsiRNAは塩基の相補性により特定のmRNAに付着し,標的mRNAの切断あるいは翻訳抑制が行われます。siRNAと標的mRNAの相補性が高い場合にはmRNAの切断がおこり(左図),相補性が低い場合には切断は起こらず,mRNAの分解促進 (右図)などを介した翻訳阻害が起こります。
このようなRNAiによるPTGSは真核生物の広い種に広がっているので,この機構は真核生物が誕生したごく初期の段階で獲得されてメカニズムだと考えられます。RNAiは,翻訳阻害を通して宿主に悪影響を与えるトランスポゾンやウイルスの活性化を阻止する機構だと考えられます。
その後,micro RNA (miRNA)を介したRNAi経路が形成さることで,標的となるmRNAは外部から侵入した有害な遺伝的因子のみではなく,自己遺伝子由来のものが含まれるようになります。これは多細胞生物にみられる複雑な組織分化を支えています。
8. 陸上植物におけるTGS: RNA dependent DNA Methylationの経路
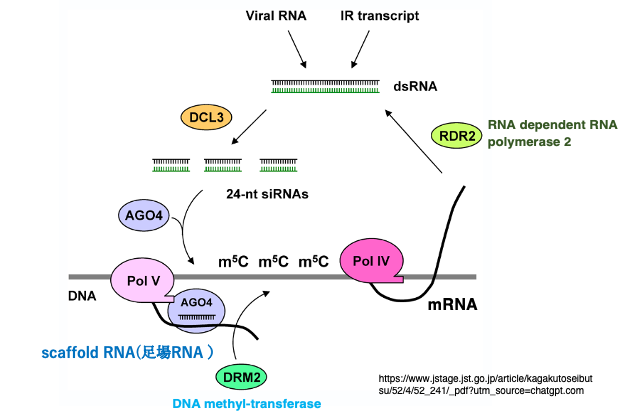
トランスポゾンや反復配列をコードする遺伝では,あらかじめ5-methylcytosine (5mC)が低頻度ながら存在している場合があります。このような遺伝子は通常のPol IIではなく,Pol IVによりmRNAが作られますことがあります。このmRNAはRNA dependent RNA polymerase 2 (RDR2) により2本鎖RNA(dsRNA)に変換されます。このdsRNAは,Dicer-like 3 (DCL3)によって24nt 長の2本鎖RNAにぶつ切りにされます。
次に,24nt-siRNAの一方がArgonaute 4 (AGO4)に取り込まれます。ここまでの反応は,従来から知られているPTGS型のRNA interferenceと基本的には同じ反応です。PTGSでは21ntまたは22ntのsiRNAが形成されるのに対して,RdDMでは24nt長のRNAが形成されるのが特徴的です。
RdDMに特異的な反応として,Pol IVが転写したのとほぼ同じDNA領域が,Pol Vによっても転写されます。転写されたRNAはscaffold RNA(足場RNA)と呼ばれます。このscaffold RNAに,AGO4が内部のsiRNAが塩基相補性を利用して結合します。
そこにde novo DNA methyltransferaseの一種である DRM2 (Domains Rearranged Methyltransferase 2)が呼び込まれます。DRM2はCG、CHG, CHHの区別なくAGO4が結合した位置の±200〜500 bpの範囲にあるDNA鎖のCにメチル化修飾を施します。これが,24nt siRNAを介したde novo なDNA methylation,つまりRdDMの概要です。24nt長のsiRNAが塩基の相補性を利用して標的DNA配列に付着するのではなくscaffold RNAに付着して,DNAメチル化酵素(DRM2)を呼び込むことで,AGO4が滞留している周辺DNA配列中のCのメチル化が行われます。
9. RdDM特異的RNA polymerase:Pol IIから進化したPol IV, Pol V
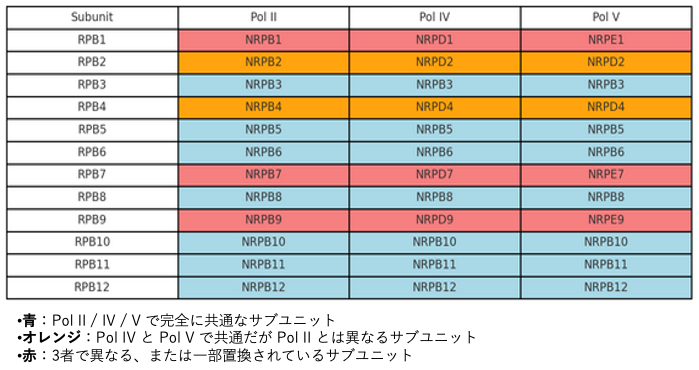
RdDMに関与する特異的な分子としてRNA polymerase IVとVがあります。これらは,タンパク質コードする遺伝子の転写に使われるPol IIから進化した分子で,Pol IIと同様に12個のサブユニットで構成されています。
この図では,これらの3種類のRNA polymeraseで共通なサブユニット7個を水色で、3種で異なるサブユニットが3つを赤色で,またPol IVとPol Vでのみ共通なサブユニットが2つ をオレンジ色で示しています。もう少し厳密には,Pol IVとPol Vは陸上植物の中でも被子植物と裸子植物のみに存在していて,コケ植物やシダ植物では存在しません。したがって,RdDMは植物の中でも被子植物と裸子植物に特有の経路です。
10.裸子植物や被子植物に見られるDNAのメチル化
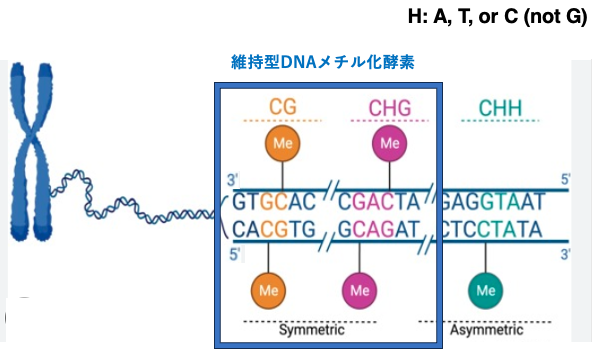
動物のゲノムに見られるメチル化はCG配列のCのメチル化ですが,裸子植物や被子植物ではCHGやCHH配列内のCにもメチル化修飾が見られます。ここでHはA,T,またはC (not G)を示しています。
CGおよびCHG配列の場合,相補鎖の対象的な位置にCがあらまれますが,CHHの場合は,相補鎖中にCは生じません。維持型のDNAメチル化酵素は,塩基配列の対称性を利用して元のDNA鎖のCにメチル化があった場合,相補鎖内の対象点にあるCにメチル化修飾を施すことができます。その結果,CGとCHGのメチル化修飾はDNA複製を経てもある程度,維持されますがCHHのメチル化の維持は難しくなります。
11. DNAメチル化とヒストン修飾を介した安定な遺伝子発現抑制
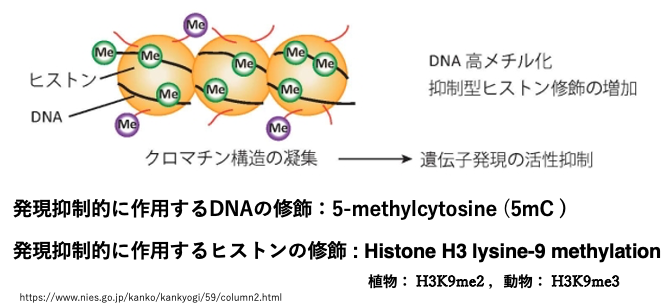
真核生物では遺伝子の発現を長期安定的に抑制するために,DNAのシトシンのメチル化(5-methylcytosine, 5mC)とヒストン修飾が協調して働きます。
DNAのメチル化とヒストン修飾により,クロマチンの凝集が誘導され,ユークロマチンはヘテロクロマチンへと変化します。
ヘテロクロマチン領域にある遺伝子には,RNA polymeraseが容易にはアクセスできないので,転写開始が強く抑制されます。
植物においてロマチン凝集に関わる代表的なヒストン修飾としては, H3ヒストンの9番目のアミノ酸であるリシン(K)に2個のメチル基を導入されたH3K9me2あります。一方,動物では,遺伝子発現を抑制するヒストン修飾の代表例として,リシンが3個のメチル化修飾を持つH3K9me3があります。
12. TGSの起点となるシトシン塩基のメチル化修飾
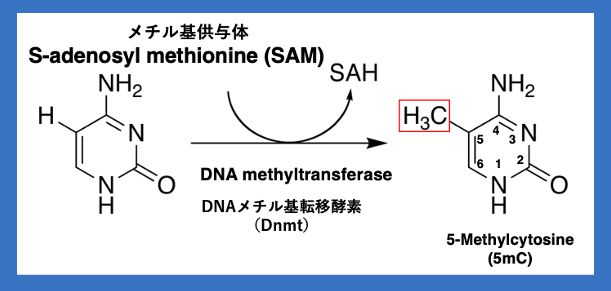
RdDMによるDNAのメチル化修飾というのは C塩基のメチル化修飾を指します。C塩基の5位にある炭素に結合しているHがメチル基に置換されます。この時のメチル基の供与体はS-adenosyl methionine (SAM)です。
13. DNAメチル化による転写開始抑制のメカニズム
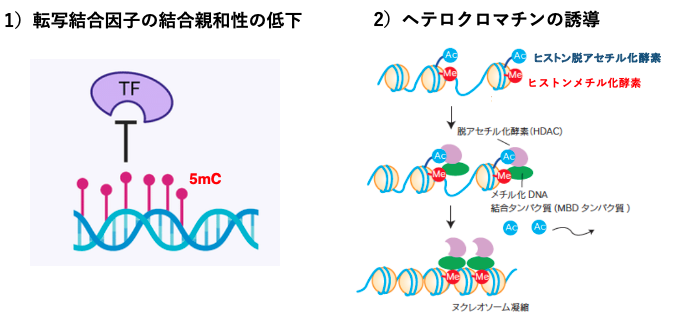
5mCが遺伝子の転写開始を抑制するメカニズムは2系統あると考えられます。一つ目の機構は
1)転写因子(TF)のDNAへの結合が阻害されることに因ります。
プロモーターやエンハンサーに結合すべき転写因子(TF)が,その認識配列がメチル化されている為に結合親和性が低下する。その為に,転写開始頻度が下がるという機構です。2つ目の機構は
2)5mCの存在がマーカーとなり,ヒストン脱アセチル化酵素やヒストンメチル化酵素などがリクルートされヒストン修飾が起こる。それにより,クロマチンがヘテロクロマチン化する事に因ります。そのため,Pol IIや転写開始複合体がDNAにアクセスできなくなるので転写開始が阻害される。
これらの機構により5mCは転写開始に対して抑制的に作用します。一方でメチル化CがDNA配列中に存在していても転写を開始したRNA polymeraseについて,転写速度が減速したり,途中で停止したりすることはなく,いったん転写がスタートすれば5mCがないDNA鎖と同様に転写することが可能です。
14. 2本鎖DNAにおけるC位置の対称性
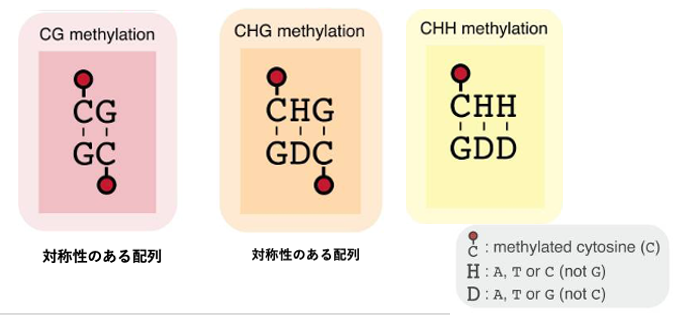
CGとCHG(H=A, T, C, not G)は2本鎖DNAを考えた場合,Cの位置に関して対称性のある配列ですが,CHHではその相補鎖にはCが含まれません。
15. ヘミメチル化鎖のメチル化:CGとCHGの場合
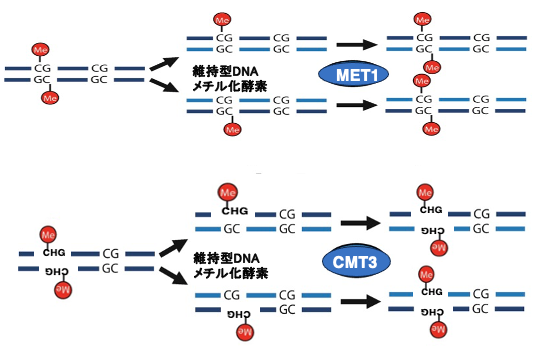
5mC修飾を持つDNAが複製されると,親鎖には5mCが残りますが新生鎖 (娘鎖)のCにはメチル化修飾がないヘミメチル化状態となります。
CG配列の場合,維持型DNAメチル化酵素のMET1は,親鎖mCGの対象点にある新生鎖内のCにメチル化修飾を導入します。その結果,DNA複製後も複製前と同様に両方の鎖においてCのメチル化修飾はDNA複製後も維持されることになります。CHG配列の場合は維持型DNAメチル化酵素であるCMT3により,娘鎖の Cがメチル化される場合がありますが,CMT3が働くためにはある条件があります。
16. ヘミメチル化鎖のメチル化:CHHの場合
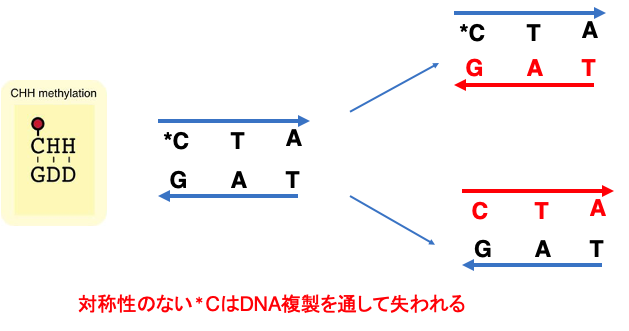
一方でCHHの場合,娘鎖に親鎖の対象点にCは現れません。従って,CHH内のメチル化はDNA,DNA複製を通して失われやすいメチル化修飾と言えます。
17. H3K9me2ヒストン修飾を介した新生鎖内のメチル化修飾
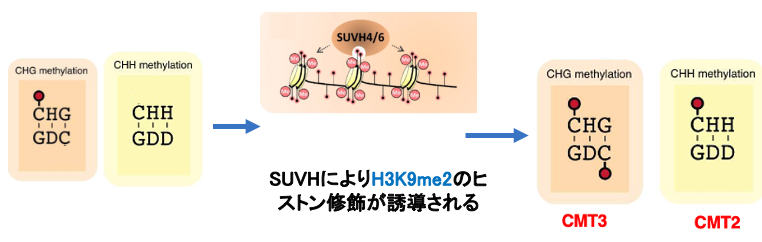
CHG配列の対象点にあるCはその配列周辺にあるヒストンがH3K9me2の修飾を受けている場合は,維持型DNAメチル化酵素であるCMT3が活性化されて効率良くメチル化されます。一方,CHHのCにメチル化修飾がない場合でも,同様にヒストンがH3K9me2の修飾を受けている場合は,CMT2によりメチル化修飾を受けることがあります。
18. 配列contextによるCのメチル化頻度の違い
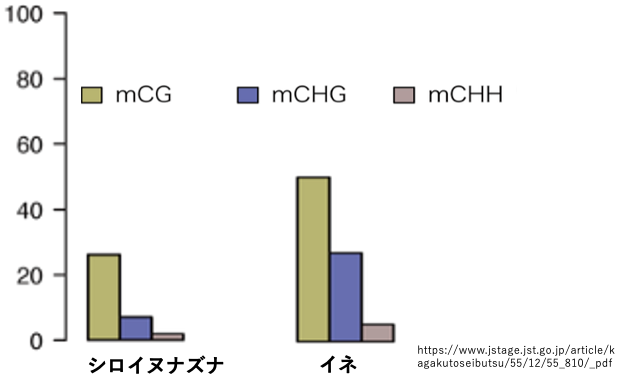
この図はシロイヌナズナとイネにおいて Cのメチル化頻度が,その配列contextによってどのように違うかを,CG, CHG, CHHの場合に分けて示しています。両方の種で,CGのメチル化頻度が最も高くCHHのメチル化率が最も低くなっています。これはCGのメチル化が維持型DNAメチル化酵素MET1によって,比較的効率よく維持される事に因ります。
19. RdDMによるde novoなCのメチル化導入
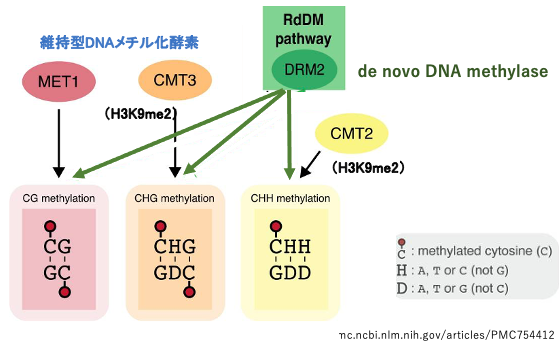
CG配列についてはヒストンにH3K9me2の修飾がなくても,維持型DNAメチル化酵素MET1によって娘鎖の対象の位置にあるCはメチル化されます。
一方,CHG, CHHについては,ヒストンにH3K9me2修飾が導入されていれば,DNAメチル化酵素CMT3, CMT2が新生鎖内のCHG, CHHにメチル化修飾を導入できることは,すでに説明をしました。 一方,RNA dependent DNA Methylationの機構が作用するとde novo methylase DRM2によりCG, CHG, CHHの区別なく5mCが導入されます。
20. 詳細なRNA dependent DNA Methylationの経路
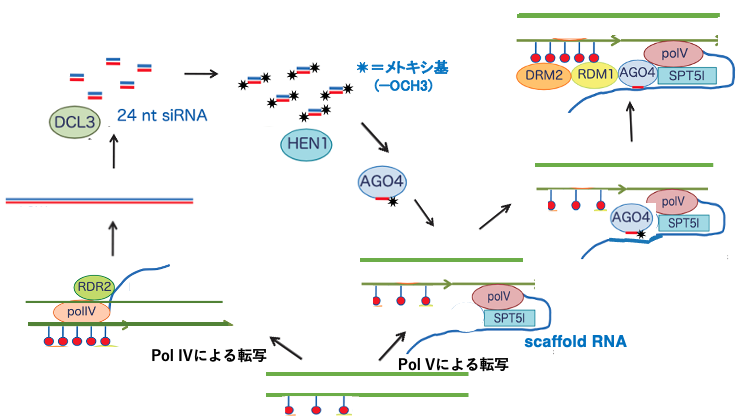
もう少し詳しいRdDMの経路をこの図で説明します。トランスポゾンや反復配列などで,その配列内にすでに少量のメチル化シトシンが存在する場合,そのような遺伝子は通常のPol IIではなくPol IVで転写されることがあります。
このPol IVで転写されたmRNAはRNA dependent RNA polymerase (RDR)2によってdsRNAに変換されます。このdsRNAはDCL3によって,通常の21ntではなくそれよりも少し長い24ntのsiRNAに切断されます。この24ntのsiRNAの3’末端はHEN1により2’- OH基がメチル化 (2′-O-methylation)され,メトキシ基 (−OCH3)となることで安定化します。
Pol IVで転写されたのと同じトランスポゾンはPol Vでも転写されます。このPol Vの転写物はscaffold RNAと呼ばれます。24nt-siRNAの一方を取り込んだAGO4がscaffold RNAに,その内部にある24nt-siRNAの塩基相補性により付着します。
scaffold RNAにAGO4が結合すると,さらにRDM1 (RNA-DIRECTED DNA METHYLATION 1)とde novo DNA methyltransferaseであるDRM2が呼び込まれます。
DRM2はCG、CHG, CHHの区別なくsiRNA標的配列の±200〜500 bpの範囲にあるCにメチル化修飾を施し,元々トランスポゾン遺伝子内にあったメチル化シトシンの頻度よりも高い状態に変化させます。このようにしてscaffold RNAに付着したAGO4が存在する近傍のDNA配列には,多くの5mCが導入されます。また,DNAがメチル化修飾されることで,その周辺のヒストンにH3K9m2の修飾が起こります。その結果としてこの領域はヘテロクロマチン状態をとることになります。これが標準的なRNA dependent DNA Methylationによる転写抑制の経路です。
21. 新たに侵入した有害な遺伝的因子に対する非標準的なRdDM
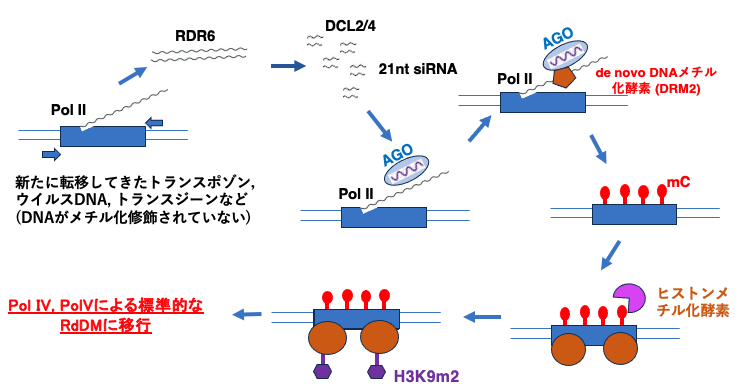
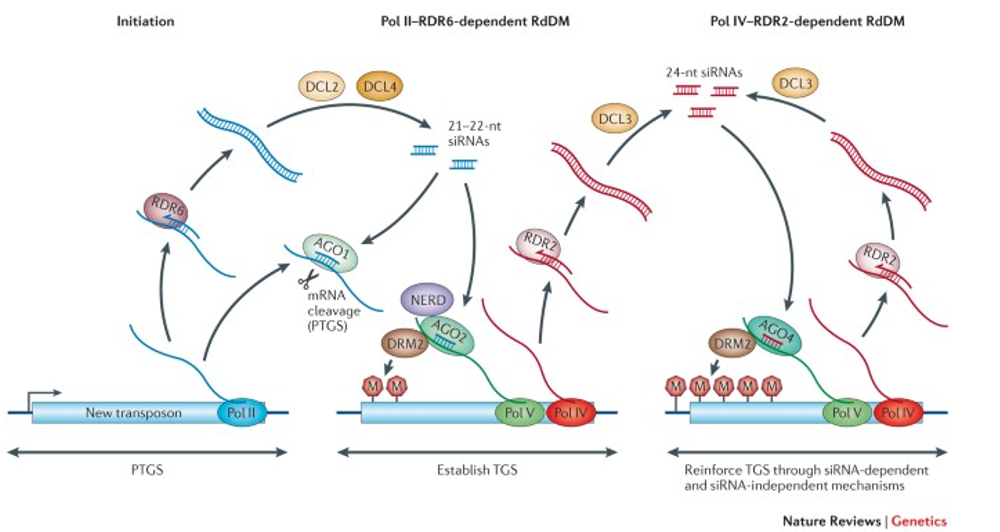
新たに転移してきたトランスポゾンや,遺伝子操作により外部から加えられたtransgene,感染により新たにゲノム内に挿入されたウイルスDNAには,まだそれらのcoding領域には5mCがありません。これら新規に転移してきた有害な遺伝的因子に対しては,先ほど説明したPol IVやPolVを用いる標準的なRNA dependent DNA Methylationではなく,非標準的なRdDMが作用してCのメチル化修飾が施される場合があります。
この場合は,
1) Pol II が遺伝子を転写
2) そのmRNAが RNA dependent RNA polymerase (RDR6)により2本鎖RNA化され,
3) Dicer (DCL2/4) によって21または22 nt siRNAが作られる
4) Pol II (またはPol V) 転写物 がscaffold RNAとなり、そこにAGO-siRNA複合体が結合5) DRM2 が呼び込まれることでAGO-siRNA複合体の付近,200-500塩基の領域にあるCに関してde novo なDNAメチル化がおきる。
22. 非標準的なRdDMから標準的なRdDMへの移行
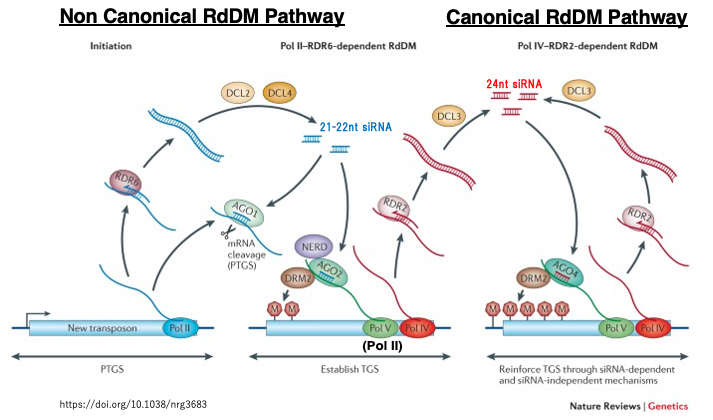
新しく侵入したトランスポゾンに対して非標準的なRdDMが作用して,その領域内のCにメチル化修飾がある程度導入されます。これにより,今度はそのトランスポゾンが標準的なRdDMにより,より多くのCがメチル化修飾を受けることになります。
この過程を以下のようになります。
新しく侵入したトランスポゾンがPol IIにより転写されると、その一部はRDR6によってdsRNAに変換され、DCL2やDCL4により21または22 nt長のsiRNAが生成されます。これらはAGO1を介してPost Transcriptional Gene Silencing (PTGS)を誘導しますが、このdsRNAの一部はAGO2に取り込まれます。活性化されたAGO2は,Pol II (またはPol V)の転に付着し,de novo DNAメチル化酵素であるDRM2を呼び込み,DRM2が5mCを周辺配列に導入します。この初期メチル化がPol IV /Pol Vをリクルートし、標準的なRdDM経路にるCのメチル化が進行します。標準的なRdDM経路の場合は,siRNAは24 ntが作られます。
23. siRNAの短距離および長距離シグナル伝達
標準的なRdDM経路で生成される24 nt 長のsiRNAはPTGS経路で生産される21-22nt siRNAと同様に師管を介して長距離移動でき、受容組織で標準型のRdDMを異所的に誘導することが実験的に実証されています。この現象は接ぎ木、ウイルス防御、世代間情報伝達など植物の多様な生理現象に関与しています。
こうした全身的なRdDMの拡散は、ストレス応答情報を生殖系列へ伝達し次世代での耐性に寄与しています。またsiRNAは原形質連絡(プラズモデスマータ)を介して近傍細胞間に移動できることも知られています。
コメント